
编者按:本文来源新康界,创业邦经授权转载。
11月12日,微信公众号“兽楼处”发表了一篇口吻戏谑的文章,名为《兽爷丨江湖就是人情世故》。秉承了“兽爷”一贯的江湖娱乐笔法,以近年来学术界少部分人的学术不端起笔,借助错综复杂的人际关系,牵强附会,转而对中国创新药代表企业乃至整个行业频频发难。
文章巧妙糅合热点,借力渲染,略有文采。然而,作者作为非专业人士,文中多处显露出其对于创新药行业的不理解、甚至是误解,略显荒腔走板,然而极有可能会误导不了解行业的公众。下面以文中大篇幅抨击的君实生物为例,摘选出其中显而易见的不实之言,略加解释,还公众以真相。
创新药企业的研发管线
图表1. 原文不当言论之一

来源:微信公众号“兽楼处”(本文全部图片均可点击放大观看)
作者不经过调查,便草率得出君实生物的“唯一”目标是研发抗PD-1单抗(图表1)。对于创新药研发企业来说,孤注一掷研发单一项目风险极高。根据Nature(自然)旗下期刊NatureReviews Drug Discovery于2019年8月发表的文章“Trends in clinical success rates and therapeutic focus”统计,对于抗肿瘤药(anticancer),从临床I期试验到最终上市的成功率仅有9%(图表2)。创新药企业通常会同时进行多个创新药的研发,做到“东方不亮西方亮”,以分散风险。
图表2. 不同治疗领域和临床阶段的药物上市概率
 来源:Nat. Rev. Drug Discov.,中康产业资本研究中心
来源:Nat. Rev. Drug Discov.,中康产业资本研究中心
在2012年10月创立之初,君实生物就至少拥有两个项目:(1)共同开发的重组人源化单抗UBP1213,靶向BLyS(B淋巴细胞刺激因子),潜在治疗系统性红斑狼疮(SLE),对标美国FDA于2011年批准上市的人源抗BLyS单抗belimumab(贝利木单抗);(2)重组人源化PD-1单抗JS001(即后来的特瑞普利单抗)。
截至目前,君实生物主要通过自主研发,结合少量共同开发和权益引进,已经建立具有一定规模的产品研发管线,20+项目覆盖肿瘤、慢性疾病、自身免疫、神经系统和抗感染5大治疗领域(图表3)。产品管线中的多个项目,如PD-1单抗JS001、PCSK9单抗JS002、新冠病毒S蛋白中和抗体JS016等,在国内处于突出水平。
图表3. 君实生物的产品研发管线概况(2020.11.13)
 来源:公司官网,中康产业资本研究中心
来源:公司官网,中康产业资本研究中心
对于创新药企业未盈利的认知
图表4. 原文不当言论之二
 来源:微信公众号“兽楼处”
来源:微信公众号“兽楼处”
作者在此处暴露出对于创新药企业,特别是生物技术公司的认识不足,也显示出对于资本市场政策的生疏。
创新药的研发过程漫长,通常包括靶点确证,先导化合物合成、筛选与优化,临床前研究,提交临床试验申请,I-III期临床试验,提交上市申请,以及上市后监测(图表5)。研发周期通常旷日持久,而且需要耗费大量的资金,尤其是III期临床试验环节。对于创新药,业界在多年前便有“3个10”的通俗说法,即研发持续10年、耗费10亿美元、销售额10亿美元。在有创新药上市之前,亏损是创新药研发企业的“常态”。即使有少数企业提供CRO(合同研究)服务,或者代理其他企业成熟产品,但往往仍是入不敷出,还分散了研发精力。
图表5. 创新药研发过程示意
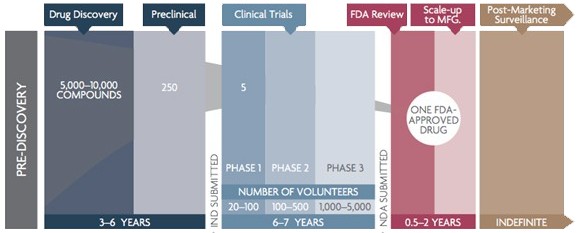 来源:PhRMA,中康产业资本研究中心
来源:PhRMA,中康产业资本研究中心
虽然风险投资/私人股权投资(VC/PE)能够给部分创新药研发企业提供一些资金,但仍然不能充分满足需求,而且限制了企业的研发规模。鉴于创新药行业的特殊性,港交所效仿美国NASDAQ,在2018年4月修改上市规则,允许未盈利的生物技术公司上市。2018年7月,专注于研发病毒治疗药的歌礼制药在港股上市,成为内地首家“吃螃蟹”的生物技术公司。紧随其后,君实生物于2018年12月登陆港股。截至2020年11月13日,共有24家未盈利生物技术公司在港股上市,包括百济神州、信达生物、康希诺生物、君实生物、康方生物、复宏汉霖、诺诚健华、康宁杰瑞、再鼎医药、药明巨诺等,基本囊括了中国知名的生物技术公司。后来,部分企业如百济神州、信达生物、君实生物等,因为有创新药上市,从股票代码中去除了“B”标记。
科创板是上交所参考美国NASDAQ、港交所的有关规定,结合内地实际情况,独立于现有主板市场推出的新设板块,主要服务于符合国家战略、突破关键核心技术、市场认可度高的科技创新企业。生物医药是科创板重点支持的产业之一。2020年7月15日,君实生物在科创板上市,依据第五套上市标准:预计市值不低于人民币40亿元,主要业务和产品需经国家有关部门批准,市场空间大,目前已经取得阶段性成果。君实生物首日股价上涨172.07%,收于每股151元,市值达到1300亿元,这反映了资本市场对于公司的认可。
对于中国创新药研发生态的认知
图表6. 原文不当言论之三
 来源:微信公众号“兽楼处”
来源:微信公众号“兽楼处”
中美两国的国情不同,发展水平不同,研发费用不能简单比较。中国本土创新药研发过程(图表5)中各项费用几乎全部低于美国,尤其是人力资源和早期的环保成本。
此处以恒瑞医药的创新化药,VEGFR-2抑制剂阿帕替尼为例进行比较,临床试验申请(IND)于2006年4月获受理,2007年4月获得批准;上市申请(NDA)于2011年8月获受理,2014年8月获批上市,用于治疗既往至少接受过2种系统化疗后进展或复发的晚期胃腺癌或胃-食管结合部腺癌(GEJC)患者。后来又拓展适应症,针对既往接受过至少一线系统性治疗后失败或不可耐受的晚期肝细胞癌患者,开展III期临床试验。根据公司2020年2月14日发布的公告(临 2020-014),阿帕替尼项目投入的全部研发费用约3.32亿元人民币,而且这包括了前后2个适应症的开发。
君实生物的拓益开发时间较晚,考虑到货币通胀,再加上生物药研发成本稍高于化药,12亿元几乎是阿帕替尼研发费用的4倍,给人感觉似乎还多花了一些,并不算少。
图表7. 原文不当言论之四
 来源:微信公众号“兽楼处”
来源:微信公众号“兽楼处”
2015年1月21日,君实生物关于重组人源化抗PD-1单克隆抗体注射液的临床试验申请(CXCL1400138)获得原国家食药监局(CFDA)受理,注册分类为1类治疗用生物制品。2016年1月14日,CFDA发送临床试验批件。君实抗PD-1单抗的临床申请从提交到获批不满一年,相对于以前的创新药可能略快。
应当承认,君实生物确实比较幸运,适逢中国药监政策大刀阔斧的改革时代。2015年8月,国务院发布关于改革药品医疗器械审评审批制度的意见(国发〔2015〕44号文),即药监政策改革纲领44号文,其中重要的一方面就是加快药品审评审批,解决申请积压的问题。
2018年7月,国家药监局(NMPA)发布《国家药品监督管理局关于调整药物临床试验审评审批程序的公告(2018年第50号)》,提出临床试验申请60日默示许可制。按照政策规定,自受理缴费之日起60日内,未收到药审中心(CDE)否定或质疑意见的,申请人可以按照提交的方案开展临床试验。相对于美国FDA的30日默示许可制,中国的政策已经比较谨慎。2018年11月3日,CDE官网公布了首批临床试验申请默示许可。假如君实的临床试验申请晚些提交,还可以更快(60天内)。
对创新药临床试验的认知
图表8 原文不当言论之五
 来源:微信公众号“兽楼处”
来源:微信公众号“兽楼处”
根据国家现行药物临床试验管理规范(GCP),不良事件(AE, adverse event)是指患者或临床试验受试者在接受一种药品后发生的任何不良医学事件,但不一定与治疗有因果关系。不良事件可以是任何无益或非期望体征(包括实验室检测发现异常)、症状或在药物使用期间伴随发生的暂时疾病,无论这种疾病是否与药物有关。可见“不良事件”的定义相当宽泛,包括了多种情况。在一般情况下,不良事件与不良反应可以通用。
“所有不良反应发生率”指临床研究中,所有研究者判断的所有级别不良事件发生的概率,根据与治疗的关系,包括肯定相关、很可能相关、可能相关、可能无关和无法判定。可见这一概念的覆盖范围也是相当广泛。
俗话说“是药三分毒”,因为人体生命过程极其复杂,几乎使用任何药物都会出现不良事件。在抗肿瘤药物,人们熟知化疗都会带来严重的不良反应,包括呕吐、脱发、中性粒细胞减少等,甚至需要使用其他药物来缓解这些不良反应。靶向药物相对于化疗有了很大进步,通常只与1个或几个靶点发生作用,但这并不意味着与其他靶点绝对没有作用,只是相对于主要靶点较弱而已。即使是抗PD-1/PD-L1单抗这样的靶向药物,仍然有较多的不良反应,如Keytruda(可瑞达,K药)在说明书中标注的单药治疗常见不良反应包括:疲倦、肌肉骨骼疼痛、食欲减退、瘙痒、腹泻、恶心、皮疹、发热、咳嗽、便秘等。特瑞普利单抗的“所有不良反应发生率”属于同类药物中较低水平(图表9)。
图表9. 国产PD-1单抗关键临床中不良反应发生率
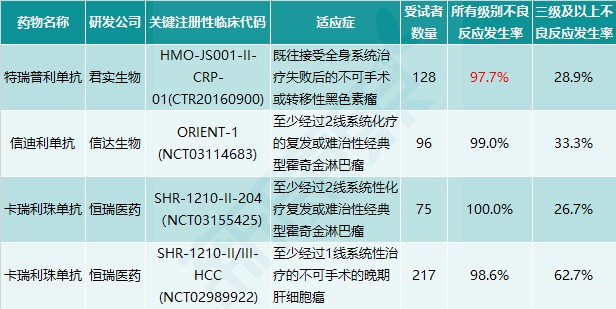 来源:公开信息,中康产业资本研究中心
来源:公开信息,中康产业资本研究中心
不良事件对于创新药来说基本是无法避免的,关键是评估风险/获益,当获益的意义或价值超过风险,使用药物相对合理时,药品便可以获批上市,而不能因噎废食。
创新药临床试验对于受试者有一定的入排标准,必须满足严格的条件才能入组。君实生物在3项临床I期试验中评估了轻度肝肾功能异常患者的药代动力学。为患者安全考虑,在关键注册临床研究(II期试验有条件上市)中排除了中重度肝功能或肾功能异常患者。
特瑞普利单抗说明书中对于特殊人群用药做出明确说明:在中重度肝/肾功能损伤患者中的安全性和有效性尚未建立,不推荐使用;轻度肝/肾功能损伤患者应在医生指导下谨慎用药。公司将肝/肾功能损伤患者作为重要的缺失患者人群纳入上市后风险管理计划,强调临床医生在上市后真实世界使用特瑞普利单抗时,应根据个体患者的实际情况,注意监测和管理,同时严格按说明书执行免疫相关器官毒性管理指南。
关于与礼来的合作
图表10. 原文不当言论之六
 来源:微信公众号“兽楼处”
来源:微信公众号“兽楼处”
君实生物新冠中和抗体的研发进展较快,今年2月初就开始推进抗体产业化工作,3月即与中科院微生物研究所正式签订了共同开发新冠中和抗体的合作协议,从康复期病人体内快速筛选并在体外重组表达具有高度病毒中和能力的全人源单抗JS016。临床前研究显示,JS016对新冠病毒刺突蛋白(S蛋白)的受体结合区域(RBD)表现出极高的特异性亲和力,达到nM水平,能够抢先与病毒结合,从而从源头阻断病毒入侵宿主细胞。在有效性方面,JS016在恒河猴动物感染实验中表现出治疗和预防效果,相关数据在线发表于国际权威期刊Nature(自然),这是全球首个报告新冠中和抗体的非人灵长类动物实验结果,引发社会广泛关注。
鉴于美国严峻的疫情,以及各大跨国药企针对新冠防治展开的研发竞赛,礼来(Eli Lilly)以高价与君实生物就JS016达成合作完全可以理解,研发成功将会给礼来带来巨大的社会声誉和经济利益。然而,礼来的老伙伴信达生物在新冠中和抗体上的研发较为缓慢,礼来在5月初与君实生物达成合作完全在情理之中。
根据礼来发布的新闻公告,其停止的是自研中和抗体LY-CoV555(LY3819253)与瑞德西韦的联合用药试验ACTIV-3,并未影响与君实生物合作研发的JS016。
图表11. 礼来对于暂停自研中和抗体临床试验的说明
 来源:礼来制药,中康产业资本研究中心
来源:礼来制药,中康产业资本研究中心
君实生物与礼来合作研发的JS016(礼来研发代码为LY-CoV016,LY3832479)的II期临床研究BLAZE-1(NCT04427501)仍在进行中,针对LY-CoV555+LY-CoV016联合用药,在近期被确诊的新冠肺炎门诊患者中进行评估。根据clinicaltrials.gov网站显示,NCT04427501试验信息在11月10日进行了更新,患者仍在招募中。
图表12. 礼来与君实合作抗体的研发进展
 来源:礼来制药,中康产业资本研究中心
来源:礼来制药,中康产业资本研究中心
结 语
我国创新药发展尚处于初期阶段,加上处于资本市场关注焦点,行业出现一些瑕疵、引起一些争议在所难免。微信公众号“兽楼处”虽然大胆尝试对中国创新药行业进行解读,勇气可嘉,然而囿于对行业和国家政策的认知,文章表述难免偏颇。本文尝试对原文中不当之处略加解释说明,希望能够增进公众对于中国创新药行业的了解,进而拥护并支持创新药研发。毕竟,高昂的新药费用的下降,离不开这些研发者、企业背后的付出。
向孜孜不倦、勇敢无畏的中国创新药研发者致敬,祝中国创新药行业明天更美好!
本文为专栏作者授权创业邦发表,版权归原作者所有。文章系作者个人观点,不代表创业邦立场,转载请联系原作者。如有任何疑问,请联系editor@cyzone.cn。








