
「医线」是创业邦推出的医疗健康栏目,立足医疗健康一线,捕捉行业内最新动态,尝试洞察创投新趋势。
医线周报,为你挑选过去一周(9.5-9.11)最值得关注的「医线」新闻。
整理| 高嵩
Part.1
COVID-19抗疫疫苗最新进展
国产新冠灭活疫苗实物首次亮相服贸会
9月6日,2020年中国国际服务贸易交易会上,国药集团中国生物研发的两款新冠灭活疫苗首次亮相。据了解,参展的两款新冠灭活疫苗目前均已进入最后的Ⅲ期临床试验阶段,正在阿联酋、巴林、秘鲁、摩洛哥、阿根廷等国家和地区紧锣密鼓地展开。入组接种5万人、样本人群现已覆盖115个国家,各方面进展均全球突出。与此同时,中国生物于北京和武汉两个生物制品研究所分别建设高等级生物安全生产设施,两个疫苗生产车间年产能合计可达3亿剂。(第一财经)
9家欧美生物药企签署新冠疫苗誓言
9月8日,欧美9家生物制药企业共同签署了一份关于新冠疫苗的誓言,承诺未来向全球监管机构提交COVID-19疫苗的申报资料和审批申请时,将坚守科学诚信。只有在三期临床试验结果显示足够的安全性和有效性后,才会申请批准或紧急使用授权。
这9家生物制药企业分别为:英国的阿斯利康、德国的BioNTech、英国的葛兰素史克、美国的强生、美国的默沙东(在美国和加拿大称作默克)、美国的Moderna、美国的诺瓦瓦克斯、美国的辉瑞和法国的赛诺菲。(经济观察报)
阿斯利康新冠疫苗试验暂停是由于“脊髓问题”
当地时间周三(9月9日),美国国家卫生研究院院长科林斯告诉国会参议院委员会,阿斯利康公司的冠病疫苗试验是由于“脊髓问题”而暂停。报道称,科林斯对参议院卫生教育劳工和养老金委员会表示,此次严重不良事件是横贯性脊髓炎。他说,如果阿斯利康的复审发现不良事件与疫苗有关,那么所有已经生产的疫苗都将被丢弃。然而,根据阿斯利康发言人,公司首席执行官苏博科在周三电话会议上告诉投资者,尚未得出最终诊断,诊断结论还需要进行更多测试。(新加坡《联合早报》)
俄罗斯首批新冠疫苗“有效”,英美追随“卫星五号”步伐
近期,《柳叶刀》发布了俄罗斯此前饱受学界争议新疫苗“卫星五号”(Sputnik V)临床试验数据,这项在于6月至8月间仅有76名受试者参与的开放、非随机的临床一期和二期试验显示该疫苗“没有严重的不利影响”,具有较好的安全性与耐受性,并产生了有效的抗体反应。(梅斯医学)
Part.2
一周投融资
本周全球医疗健康领域融资事件共22起,其中国内15起,国外7起。据睿兽分析不完全统计,本周国内医疗融资金额总计超过18亿人民币,海外融资金额总计约1.5亿美元。
国内融资情况如下:
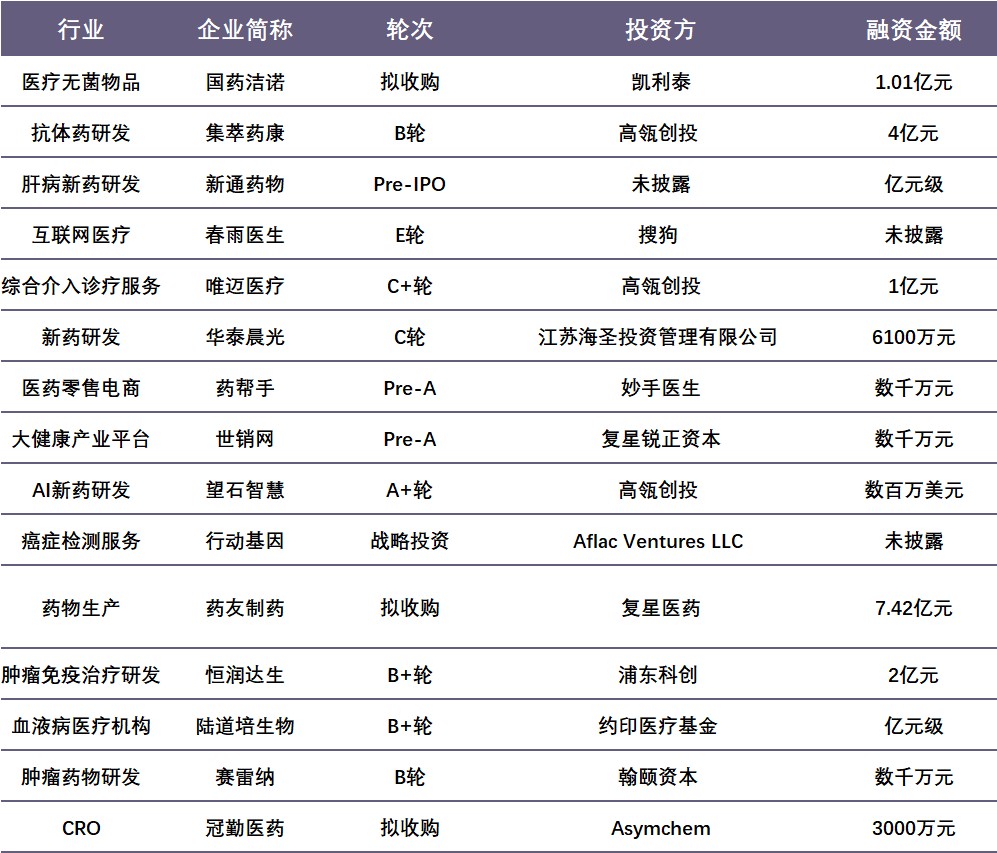
数据来源:睿兽分析
本周国内融资超1亿人民币的公司信息如下:
国药洁诺是国药控股股份有限公司旗下子公司,公司应用国际先进的感控技术和设备,整合传统的消毒供应中心的业务,满足医院个性化的需求,为各级医疗机构提供可信赖的工业化灭菌物品一站式外包解决方案和集成管理服务。公司成立于2014年10月,注册资本6300万,目前在嘉定江桥拥有近3000平米的现代化厂房,面向上海各大医院及医疗机构提供专业标准的灭菌服务。
集萃药康是一家专业从事人源化模型与药物筛选技术研发的高科技生物技术企业,具有突出的疾病模型研发创制能力和基因工程改造小鼠模型创制中心。公司旗下“人源化模型与药物筛选创新技术研究院”被江苏省产业技术研究院吸纳为“专业研究院”,成为该领域重点扶持架设产业链、国际化发展的新型研发机构。
唯迈医疗成立于2014年,是专注于介入诊疗影像设备的提供商,团队拥有15年以上的数字血管造影系统设计和产业化经验。目前,唯迈团队已完成医用血管造影机(DSA/大C)、移动血管造影机(中C)、外科C型臂(小C)等介入产品的研发与生产,以及创新介入手术机器人的研发,是国内具备全系列介入解决方案的介入诊疗设备企业。
药友制药是一家克林霉素系列产品生产商,产品主要涉及水针、粉针、输液、冻干剂、胶囊剂、片剂等十多个剂型;涵盖克林霉素系列产品、阿拓莫兰、炎琥宁等产品。
恒润达生成立于2015年7月,是一家肿瘤免疫技术研发商。利用肿瘤免疫治疗技术CAR-T,为肿瘤患者提供基于生物和细胞技术的精准治疗方案,在北京、江苏、重庆、河南等多地构建了中心临床试验平台。经过五年的发展,恒润达生组建了一支完整的、能独立推动从前端研发→CMC研究→IND申报→注册临床试验的团队,并且形成了以CAR-T技术为主导,TCR-T细胞治疗项目、CAR-NK细胞治疗项目、溶瘤病毒疗法等多个研发项目并行推进的研发格局。
北京陆道培生物技术有限公司成立于2012年4月,法定代表人为陆文昭。陆道培医疗集团是一家专注于血液病及肿瘤治疗、科研、教学为一体的民营医疗集团。经过十几年的不懈努力,目前已发展到五家医疗机构:河北燕达陆道培医院、北京陆道培医院、北京陆道培血液病医院、陆道培血液病研究院和上海道培医院。
国外融资情况如下:
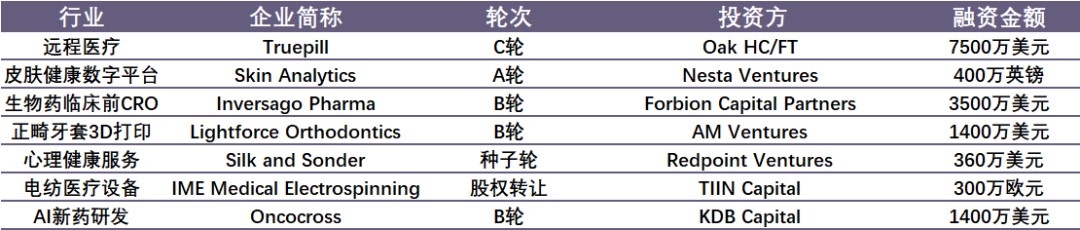
数据来源:睿兽分析
Part.3
一周政策动向
关键词:省级集采推进、查药价查成本、78个常用药退市
国家医保局出台目录,查药价、药企成本
9月7日,国家医保局发布《医疗保障行政执法事项指导目录》,在指导目录列出的15项内容中,有多项内容涉及药品价格监管以及药品招标采购。指导目录第八条规定,各级医保部门可以对药品、医用耗材价格进行监测和成本调查。指导目录第九条规定,各级医保部门可以对药品上市许可持有人、药品和医用耗材生产企业、药品经营企业和医疗机构向医药价格主管部门提供其药品、医用耗材的实际购销价格和购销数量等资料的监督检查。(国家医保局官网)
浙江药品带量采购开始,分AB组、双信封
9月8日,浙江省级药品集中带量采购座谈会在杭州星都宾馆5楼星光厅召开,《浙江省公立医疗机构部分药品带量采购工作方案(征求意见稿)》也在会上发布。从流传出来的《征求意见稿》显示,本次浙江将从未过评药品中,遴选采购金额大、竞争充分、临床使用成熟的药品组织实施集中带量采购。
总采购金额为2019年全省所有公立医疗机构年度药品总用量的50%作为总约定采购量,其中A、B组约定采购量分别按其2019年全省所有公立医疗机构采购份额确定(最高、最低约定采购量分别为该品总年度药品总用量的45%、5%)。
值得关注的是《征求意见稿》明确如A、B两组中任意一组流标,则该组约定采购量的50%归并至另一组的约定采购量,剩余50%作为约定采购量以外的剩余用量。这对于部分中选品种和未中选品种来说,都是一个好的信号。(医趋势)
药监局发文,78个常用药退市
9月8日,国家药监局发布通知称,决定注销78个药品注册证书,包括优时比的注射用前列地尔、参天制药的玻璃酸钠滴眼液、国药集团的阿莫西林胶囊、头孢拉定胶囊、头孢氨苄颗粒以及三九集团的猪免疫球蛋白口服液等78个临床常用药。
在这一批78个临床常用药品中,74个药品依申请注销,3个不予再注册和1个依法注销。其中,有两家药企注销的药品批文数量最多,他们分别是六安华源制药注销的药品批文数量达21个,国药集团精方(安徽)药业注销的药品批文数量达42个。(国家药监局官网)
Part.4
大公司&大事件
高瓴资本牵头财团对天镜生物私募配售4.18亿美元
9月4日,天镜生物宣布已与由高瓴资本和新加坡政府投资公司(GIC)牵头的机构投资者组成的财团签署最终认购协议,将会通过私募配售的方式融资约 4.18 亿美元。(天镜生物公告)
天镜生物与艾伯维达成20亿美元合作
9月4日,天境生物与艾伯维达成了一项许可协议,将其CD47单抗lemzoparlimab在大中华区以外地区的开发及商业化许可给后者,保留该项目在中国大陆、中国香港和中国澳门的开发和商业化权利。天境生物可从艾伯维获得1.8亿美元首付款,以及2000万美元I期研究里程金,8.4亿美元后续研发及注册里程金,9亿美元销售里程金,交易总额19.4亿美元。TJC4成功商业化后,天境生物还可从全球净销售额中获得两位数比例的分级特许权使用费。(天镜生物公告)
募资10亿美元,再鼎将在香港上市
目前在美国纳斯达克上市的再鼎医药(ZaiLab)(代码:ZLAB)将寻求近期通过港交所上市聆讯,并在数天内在港交所官网披露通过聆讯后的招股说明书,以最快于9月、不迟于10月完成在香港上市。据悉,再鼎医药本次预计募集约10亿美元。再鼎医药于此前于2017年9月在美国纳斯达克成功上市。如若成功登陆,将成为继百济神州后第二家美国及中国香港上市的医药企业。(药融圈)
Part.5
新产品&新技术
抗癌突破!溶瘤病毒“点燃”CAR-T疗法,一半以上小鼠被治愈
9月2日,来自美国希望之城的科学家团队以封面论文的形式在Science Translational Medicine杂志上报道了一项联合CAR-T和溶瘤病毒疗法成功靶向和根除实体瘤的突破进展[1]。
在临床前研究中,研究者们通过基因工程改造一种溶瘤病毒,使之能够进入肿瘤细胞,并迫使肿瘤细胞在表面表达CD19蛋白。之后,他们再使用靶向CD19的CAR-T细胞来识别和攻击这些实体瘤。这一创新的联合治疗方案使得约60%的小鼠肿瘤完全消退,为CAR-T应用于实体瘤治疗带来了极大的希望。(医药魔方)
基石药业RET抑制剂普拉替尼中国上市申请获受理并纳入优先审评
近日,中国国家药品监督管理局(NMPA)正式受理普拉替尼(Pralsetinib)胶囊的上市申请并纳入优先审评,用于治疗经含铂化疗的RET融合阳性的非小细胞肺癌(NSCLC)患者。(医药魔方)
万春First In Class药物普那布林获得中、美“突破性疗法”双认定
9月3日(北京时间),国家药品监督管理局药品审评中心(以下简称CDE)通过官网发布最新公示:大连万春布林医药有限公司的注射用普那布林浓溶液拟纳入“突破性治疗品种”。9月4日(美东时间),万春医药宣布收到美国食品药品监督管理局(FDA)的通知:“我们确定了普那布林预防化疗对非髓性恶性肿瘤诱导的中性粒细胞减少症(CIN)符合突破性疗法的标准。”(万春官网)
复宏汉霖贝伐珠单抗HLX04上市注册申请获国家药监局受理
9月9日,复宏汉霖宣布,公司于近期提交的贝伐珠单抗注射液HLX04(重组抗VEGF人源化单克隆抗体注射液)上市注册申请(NDA)正式获得国家药品监督管理局(NMPA)受理。(复宏汉霖官网)
君实生物特瑞普利单抗治疗鼻咽癌获得美国FDA突破性疗法认定
9月10日,君实生物宣布,由公司自主研发的抗PD-1单抗特瑞普利单抗治疗鼻咽癌已于近日获得美国食品药品监督管理局(FDA)突破性疗法认定(Breakthrough Therapy Designation)。特瑞普利单抗成为首个获得FDA突破性疗法认定的国产抗PD-1单抗,这是继2020年5月特瑞普利单抗治疗鼻咽癌获得FDA孤儿药认证后又一重要注册进展。(君实生物官网)
Part.6
言论&数据
302个品种被“劝退”,别再研发、申报了!
9月7日,中国药学会发布《关于发布第六批过度重复药品提示信息的公告》,公布了《同一药品已获批准文号企业数在20家以上的过度重复品种目录(第六批)》,涉及302个品种,与第五批过度重复品种目录相比,本次调整1个品种出目录,不再列为过度重复药品。
公告显示,该目录对已获批上市药品在2017-2019年间的销售情况进行监测分析,形成第六批过度重复药品提示信息目录,涉及临床药理学和治疗学分类的14个大类、60个亚类。(E药经理人)
疫情下的中国医药半年报:营收仅医疗器械增长,迈瑞净利润反超恒瑞
A股上市的346家医药生物企业发布的2020年上半年年报,行业整体归母净利润上涨15.04%,医疗器械翻倍。346家医药生物企业营业收入合计为8515.37亿元,与2019H1基本持平,但归母净利润812.26亿元,同比增长15.04%。医药商业企业普遍有较高的营业收入,在营收排行榜前10强中占据8席;医疗器械企业有较快的增速,营收增速和归母净利润增速均位居六大细分领域首位,并远超其他领域;而医疗服务和生物制药企业有较高的估值,市盈率超50。
行业净利率上升1.92pct,销售费用减少而研发费用增大。行业总体毛利率为34.94%,与2019H1基本持平,净利率为10.25%,同比上升达到1.92pct。行业累计销售费用为1257.45亿元,同比下降10.39%;累计研发投入234.01亿元,同比增长17.33%,研发占总营收的比例为3.03%,同比增长0.48pct。(新康界)





